هیدروکلریک اسید با فرمول شیمیایی HCl، که از دو عنصر هیدروژن و کلر تشکیل شده، مایعی شفاف و بوی بسیار تند است که اولین بار در در حدود سال ۸۰۰ میلادی و با مخلوط کردن نمک معمولی با اسید سولفوریک توسط جابر بن حیان کشف شد.
پس از آن در قرن پانزدهم میلادی هیدروکلریک اسید با استفاده از واکنش سنگ نمک و ویترول سبز توسط والنتیوس با عنوان اسید موریاتیک تولید گردید اما استفاده هیدروکلریک اسید با فرمول شیمیایی HCl، که از دو عنصر هیدروژن و کلر تشکیل شده، مایعی شفاف و بوی بسیار تند است که اولین بار در در حدود سال ۸۰۰ میلادی و با مخلوط کردن نمک معمولی با اسید سولفوریک توسط جابر بن حیان کشف شد.
پس از آن در قرن پانزدهم میلادی هیدروکلریک اسید با استفاده از واکنش سنگ نمک و ویترول سبز توسط والنتیوس با عنوان اسید موریاتیک تولید گردید اما استفاده گسترده از این ماده شیمیایی در آزمایشات علمی به وسیله شیمی دانانی مانند گلاوبر و دیوی و پریستلی صورت پذیرفت.
هیدروکلریک اسید که با نامهای دیگری همچون اسید کلریدریک، اسید موریاتیک، جوهر نمک و کلرید هیدرونیوم نیز شناخته میشود از لحاظ ساختاری خطی است و وزن مولکولی آن ۳۶.۵ گرم/مول است. هیدروکلریک اسید خاصیته اسیدیته بسیار بالایی دارد و pH آن در دمای اتاق بین 0 تا 2 است.
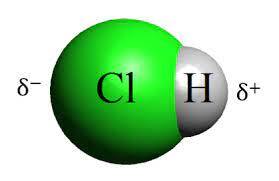
شکل (1) نشان دهنده ساختار مولکولی این اسید است.
هیدروکلریک اسید محلول در آب هیدروژن کلرید نامیده میشود و خواص فیزیکی این اسید قوی از جمله چگالی، نقطه ذوب و نقطه جوش بستگی به غلظت هیدروژن کلرید محلول در آب دارد.
همانطور که در بالا نیز به آن اشاره شد هیدروکلریک اسید یک اسید بسیار قوی با فرمول شیمیای HCl است ولی هیدروژن کلرید یک گاز با ترکیب شیمیایی HCl است. پس تنها تفاوت این دو، حالت فیزیکی آن دو میباشد.
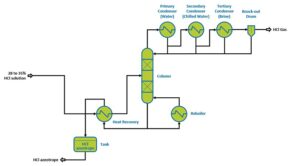
شکل (2): شمایی ساده از فرآیند تولید گاز هیدروژن کلرید از محلول هیدروکلریک اسید
فرآیند تولید هیدروکلریک اسید
هیدروکلریک اسید هم به صورت صنعتی و هم به صورت طبیعی تولید می شود.
هیدروکلریک اسید در صنعت با استفاده از فرآیندهای مختلفی تولید میگردد، از جمله این فرآیندها عبارتند از:
- واکنش سوزاندن کلر در هیدروژن
- واکنش اسید سولفوریک با کلرید سدیم
- به عنوان محصول جانبی در فرآیند کلر زنی ترکیبات آلی (معمولا در صنعت از این فرآیند استفاده میشود.)
مشاهده و ثبت سفارش هیدروکلریک اسید (HCl) در گروه راینه
در فرآیند الکترولیز، محلولی حاوی کلرید سدیم که معمولاً به آن آبنمک (brine)گفته میشود، بهعنوان ماده اولیه در یک سلول الکترولیز، با استفاده از جریان الکتریکی، یونهای کلرید از محلول جدا میشوند
و با یونهای هیدروژن (H+) ترکیب شده و اسیدکلریدریک تولید میشود. در روش دیگری، گاز کلر (Cl2) در تماس با آب تبدیل به هیدروکلریک اسید میشود.
در یک فرآیند نیز ترکیبات کلریدی مانند کلرید سدیم (NaCl) یا کلرید هیدروژن (HCl) با منابع حرارتی قوی، مانند سولفات مس (CuSO4) تماس داده میشوند سپس در این فرآیند، ترکیبات کلریدی تجزیه شده و کلر (Cl2) آزاد شده با آب ترکیب میشود و اسیدکلریدریک تولید میگردد.
در فرآیند دیگری،گاز هیدروژن (H2) با گاز کلر (Cl2) ترکیب میشود و تحتتأثیر یک فلز کاتالیزور مانند پالادیم (Pd) یا پلاتین (Pt) منجر به تشکیل اسید کلریدریک میگردد.
باید توجه داشت تولید اسیدکلریدریک به صورت صنعتی ممکن است با استفاده از روشهای دیگر نیز صورت بگیرد و هر روشی ممکن است وابسته به نیازها و شرایط محیطی برای تولید این ماده شیمیایی مورد استفاده قرارگیرد.
6 واکنش مهم هیدروکلریک اسید
در ادامه به برخی از مهم ترین و متداول ترین واکنشهای هیدروکلریک اسید آورده شده است.
هیدروکلریک اسید در واکنشهای گسترده ای شرکت میکند و محصولات فرعی تولید شده در اثر تجزیه این اسید عبارتند از:
- کلرید هیدروژن
- کلرید سدیم
- کلر
- مونو کسید کربن
- دی اکسید کربن
- گاز هیدروژن
1- واکنش هیدروکلریک اسید با فلزات فعال
هیدروکلریک اسید با فلزات واکنش داده و گاز هیدروژن آزاد نیکند. برخی از این واکنشها در زیر ارائه شده است:
Ca+2HCl→CaCl2+H2 واکنش هیدروکلریک اسید با کلسیم
Mg+2HCl→MgCl2+H2 واکنش هیدروکلریک اسید با منیزیم
Fe+2HCl→FeCl2+H2 واکنش هیدروکلریک اسید با آهن
Zn+2HCl→ZnCl2+H2 واکنش هیدروکلریک اسید با روی
2- واکنش هیدروکلریک اسید با بازها
هیدروکلریک اسید با بازهای مختلف مانند اکسیدهای فلزی و هیدروکسیدها واکنش میدهد. محصول این واکنشها که به واکنشهای خنثی شدن معروف هستند، آب و نمک است. برخی از این واکنشها در ادامه آورده شده است:
ZnO+2HCl→ZnCl2+H2O واکنش هیدروکلریک اسید با روی اکسید
MgO+2HCl→MgCl2+H2O واکنش هیدروکلریک اسید با منیزیم اکسید
NaOH+2HCl→NaCl+H2O واکنش هیدروکلریک اسید با سدیم هیدروکسید
Ca(OH)2+HCl→CaCl2+2H2O واکنش هیدروکلریک اسید با کلسیم هیدروکسید
3- واکنش هیدروکلریک اسید با کربناتهای فلزی و بی کربناتها
هیدروکلریک اسید با ترکیبات کربنات فلزی یا بیکربناتها واکنش داده و گاز دی اکسید کربن آزاد میکند، برخی از این واکنشها در ادامه آورده شده است:
Na2CO3+2HCl→2NaCl+H2O+CO2 واکنش هیدروکلریک اسید با سدیم کربنات
NaHCO3+HCl→2NaCl+H2O+CO2 واکنش هیدروکلریک اسید با سدیم بی کربنات
Ca(HCO3)2+2HCl→2CaCl2+2H2O+2CO2 واکنش هیدروکلریک اسید با کلسیم بی کربنات
Mg(HCO3)2+2HCl→MgCl2+H2O+CO2 واکنش هیدروکلریک اسید با منیزیم بی کربنات
4- واکنش با سولفیدهای فلزی
محصول واکنش هیدروکلریک اسید و سولفیدهای فلزی سولفید اکسیژن است. در ادامه دو نمونه از این واکنشها آورده شده است:
ZnSO3+2HCl→ZnCl2+H2O+SO2 واکنش هیدروکلریک اسید با هیدروسولفیت سدیم
Na2SO3+2HCl→2NaCl+H2O+SO2 واکنش هیدروکلریک اسید با سدیم سولفیت
5- واکنش با نیترات نقره
محصول واکنش میان هیدروکلریک اسید با نیترات نقره، رسوبی سفید رنگ به نام کلرید نقره است. این واکنش در ادامه آورده شده است:
AgNO3+HCl→AgCl+HNO3
6- واکنش با نیترات سرب
اسید هیدروکلریک با نیترات سرب واکنش داده و محصولی به صورت رسوب سفید گچی به نام کلرید سرب تولید میکند. این واکنش در ادامه آورده شده است:
Pb(NO3)2+2HCl→PbCl2+2HNO3
کاربردهای هیدروکلریک اسید
“استفاده از هیدروکلریک اسید در صنایع شیمیایی برای تولید نمکها، تنظیم pH و فرآیندهای شیمیایی اساسی اهمیت بسیاری دارد.”
1- کنترل و تنظیم pH
هیدروکلریک اسید در تنظیم اسیدیته محلولها و همچنین برای کنترل pH محصولات دارویی، آب و غذاها استفاده می شود.
2- صنایع غذایی
هیدروکلریک اسید در صنایع غذایی در محصولاتی مانند شربت، کوکی، کراکر، سس، نوشابه، غلات و محصولات کنسرو شده برای افزایش طعم و جلوگیری از فساد مورد استفاده قرار می گیرد.
3- عامل پاک کننده
هیدروکلریک اسید که با عنوان جوهر نمک نیز شناخته میشود به دلیل خاصیت اسیدی قوی به عنوان یک ماده شیمیایی مفید برای از بین بردن لکه ها، نظافت کاشی حمام و آشپزخانه و همچنین جهت سفید کردن لباس در صنعت نساجی به کار میرود.
4- شست و شوی صنعتی و رفع زنگ زدگی
هیدروکلریک اسید رقیق در حذف زنگ زدگی یا اکسید آهن از فولاد و آهن به کاربرده میشود. هیدروکلریک اسید به دلیل pH کمی که دارد، توانایی جرم گیری و شویندگی بسیار بالایی دارد که شویندگی آن مربوط به مصارف خونگی نمیشود، برای مثال جرم گیری ابزار و لوله های صنعتی، باز کردن چاه های فاضلاب، جرم گیری و تمیز کردن کاشی ها از جمله کاربردهای هیدروکلریک اسید در این حوزه است.
5- تولید ترکیبات آلی و معدنی
یکی از واکنش های اساسی در صنعت که منجر به تولید مواد شیمیایی میشود، واکنش اسید و باز است. هیدروکلریک اسید در تولید ترکیبات آلی مانند وینیل کلرید و دی کلرومتان که برای تولید PVC استفاده می شود، به کار برده میشوند.
در تهیه ترکیباتی همچون پلی آلومینیوم کلراید و اسید فریک که در تصفیه آب مورد استفاده قرار میگیرند از هیدروکلریک اسید استفاده میشود. هیدروکلریک اسید همچنین با سنگ آهک واکنش داده و کلرید کلسیم تولید میکند که کاربرد گستردهای در صنایع مختلف دارد.
6- کاربرد در صنایع نظامی
فسژن یک ماده شیمیایی خطرناک است که در جنگ جهانی اول مورد استفاده قرار گرفت. فسژن یک گاز بی رنگ با بویی شبیه گیاه یونجه است که از واکنش بین مونوکسید کربن تصفیه شده و گاز کلر در حضور کربن فعال به وجود می آید.
فسژن وقتی به جای گاز کلر به عنوان سلاح شیمیایی مورد استفاده قرار میگیرد عمیقا در غشاهای مخاطی ریه نفوذ کرده و در بدن هیدرولیز می شود. سپس به اسید کربنیک و اسید کلریدریک تبدیل می شود و باعث از بین رفتن اندام های داخلی خواهد شد.
تخمین زده شده که در جنگ جهانی اول ۸۵% مرگ و میر به دلیل تنفس فسژن بوده است.
7- کاربرد هیدروکلریک اسید در ساختمان
به منظور تمیز کردن سطح دیوارهای ساختمان از واکنش بین هیدروکلریک اسید با کلسیم کربنات استفاده میشود. این واکنش تا جایی که یکی از دو ماده واکنش دهنده به اتمام برسد ادامه پیدا خواهد کرد. واکنش زیر نشان دهنده این واکنش است:
CaCO3+2HCl→CaCl2+CO2+H2O
با توجه به خورندگی بسیار بالای این ماده حین استفاده باید به علاوه بر نکات ایمنی به مراقبت در خصوص آسیب رسانی به بافت مصالح ساختمانی نیز توجه داشت.
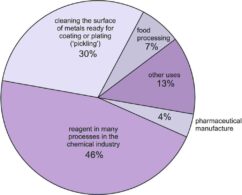
شکل (3) نشان دهنده چگونگی توزیع مصرف هیدروکلریک اسید در صنایع مختلف است.
شرایط نگهداری و ایمنی استفاده از هیدروکلریک اسید
در صورتی که هیدروکلریک اسید مطابق دستورالعمل سازنده در محل و شرایط مناسب ذخیره شود، ماندگاری آن در حدود ۵ سال است.
آژانس حفاظت از محیط زیست آمریکا، این مواد شیمیایی را جز مواد خورنده و سمی دانسته است و حفظ ایمنی در هنگام کار با آن را از ضروریات ذکر کرده است. هیدروکلریک اسید به شدت خورنده است و نوع غلیظ آن منجر به آزاد شدن مه های اسیدی بسیار خطرناکی میگردد.
1- استنشاق هیدروکلریک اسید
در صورت استنشاق آن حتی به میزان بسیار اندک منجر به التهاب در بینی، چشم و مجاری تنفسی میگردد.
2- بلعیدن هیدروکلریک اسید
در اثر تماس با دهان به مخاط دهان و معده آسیب وارد شود. قرار گرفتن طولانی مدت در معرض این اسید می تواند منجر به ورم معده منجر گردد.
3- تماس با پوست
در صورت تماس این اسید با پوست بلافاصله محل را با آب شستشو داده و لباس های آلوده را عوض کنید.
4- تماس با چشم
در صورت تماس چشمی باید فورا ۱۵ دقیقه با مقدار زیادی آب چشم را شستشو داده و سریعا به پزشک مراجعه شود.
بازار صنعتی یا اسید کلریدریک صنعتی
تولید هیدروکلریک اسید با غلظت های بالاتر از 40 درصد از نظر شیمیایی امکان پذیر است، اما به دلیل بالا بودن سرعت تبخیر نگهداری و شرایط خاص استفاده از آن در این شرایط عیار اسید کلریدریک صنعتی 30 تا 35 درصد است که برای تعادل کارایی حمل و نقل و از بین رفتن محصول از طریق تبخیر بهینه شده است.
تولید کنندگان عمده هیدروکلریک اسید در سراسر جهان عبارتند از:
- داو کمیکال (DOW Chemical)
- جورجیا گالف (Gerogia Gulf Corporation)
- شرکت توسوکوپریشن (Tosoh Corporation)
- شرکت آکزونوبل (Akzo Nobel)
کل تولید جهانی هیدروکلریک اسید حدود 20 میلیون تن در سال تخمین زده شده است که از این میزان حدود 3 میلیون تن در سال از سنتز مستقیم و بقیه به عنوان محصول ثانویه از سنتزهای آلی و مشابه تولید میگردد.