اسید سولفوریک از جمله اسیدهای قوی و از مواد شیمیایی پر کاربرد در صنایع مختلف شیمیایی است. این ماده در واکنشهای شیمیایی و فرآیندهای تولید دیگر ترکیبات شیمیایی کابرد گستردهای دارد. از جمله کاربردهای اسیدسولفوریک تولید ضد یخ، حشرهکشها، صنایع دارویی، احیای آلومینیوم، صنایع کاغذسازی، تولید دستمالکاغذی، روزنامه، جعبههای مقوایی، مواد شوینده، به عنوان حلال چربیها و لیپیدها، صنایع حفاری چاههای نفت و … میباشد.
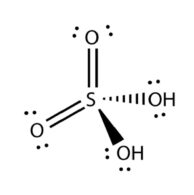
معرفی اسید سولفوریک
اسید سولفوریک برای نخستین بار توسط جابربن حیان کشف شد. او با تقطیر کانی های سولفات آهن و سولفات مس (II) این اسید را به دست آورد. اسید سولفوریک، اسیدی معدنی و بسیار قوی است که به طور طبیعی در گازهای خارج شده از آتشفشان نیز وجود دارد.
واکنش اسید سولفوریک با آب به شدت گرمازا است و میل ترکیبی زیادی با آب دارد. اسید سولفوریک خورنده است و قسمت عمدهای از باران اسیدی را تشکیل میدهد.
این ماده در گذشته با نام جوهر گوگرد نیز شناخته میشد و اسیدی بسیار قوی است که با هر درصدی در آب حل میشود. این ماده دارای مولکولهای قطبی است که میتوانند با یکدیگر پیوند هیدروژنی برقرار کنند. به همین دلیل اسید سولفوریک مایعی با نقطه جوش بالا و ویسکوز محسوب میشود.
همین شرایط مولکولی باعث میشوند که اسید سولفوریک به خوبی در آب حل شود و محلولهای اسیدی مختلف تولید کند. اسید سولفوریک میل ترکیبی زیادی با آب دارد به طوریکه در واکنش با سایر مواد، هیدروژن و اکسیژن آنها را به صورت آب جدا میکند. شکل (1) نشان دهنده شمایی ساده از فرآیند تولید اسید سولفوریک است.
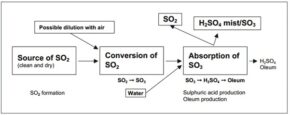
شکل (1): شمایی ساده از فرآیند کلی تولید اسید سولفوریک
مشخصات بارز اسید سولفوریک
| اسامی دیگر اسید سولفوریک : | سولفوریک اسید، سولفات هیدروژن، جوهر گوگرد، روغن ویتریول |
| فرمول ملکولی : | H2SO4 |
| جرم مولی : | 98/078 g/mol |
| شکل ظاهری : | بی رنگ و بی بو، مایع شفاف |
| انواع خلوص : | اسید سولفوریک 98 درصد ، اسید سولفوریک 50 درصد ، اسید سولفوریک 35 درصد |
| دمای جوش : | 337 C° |
| دمای ذوب : | 10 C° |
| دانسیته : | 1.8 gr/cm3 |
کاربردهای مهم اسید سولفوریک در صنایع شیمیایی
اسید سولفوریک رایج ترین ماده شیمیایی مورد استفاده در جهان است و تقریباً در تمام صنایع استفاده میشود.
- کودها
- داروسازی
- گازوئیل
- باتریهای خودرو
- صنایع خمیر و کاغذ
- سفید کننده قند
- تصفیه آب
- عوامل سولفوناسیون
- الیاف سلولزی
- تولید فولاد
- عوامل رنگ آمیزی
- واسطههای اسید آمینه
اسید سولفوریک یک مایع بسیار اسیدی و روغنی است که ممکن است از نظر ظاهری شفاف تا کدر باشد. اسید سولفوریک غلیظ هم به عنوان یک عامل اکسید کننده و هم به عنوان عامل خشک کننده عمل میکند.
در محیط زیست، اسید سولفوریک جزء تشکیل دهنده باران اسیدی است، زیرا در اثر اکسیداسیون دی اکسید گوگرد در حضور آب تشکیل میشود. دی اکسید گوگرد اتمسفر از احتراق سوخت های فسیلی حاوی گوگرد مانند زغال سنگ و نفت تولید میشود.
اسید سولفوریک زمانی به روغن ویتریول معروف بود که توسط کیمیاگر ایرانی قرن هشتم جابر بن حیان ابداع شد. این ماده توسط Johann Van Helmont در 1600 میلادی با تقطیر مخرب ویتریول سبز (سولفات آهن) و سوزاندن گوگرد تهیه شد. سوزاندن گوگرد با نمک (نیترات پتاسیم) برای اولین بار در قرن هفدهم برای تهیه اسید سولفوریک استفاده شد.
کاربردهای صنعتی اسید سولفوریک
تولید شیمیایی
به عنوان یک ترکیب شیمیایی بسیار مهم، خرید مواد شیمیایی اسید سولفوریک در فرآیند ساخت تعدادی از مواد شیمیایی شناخته شده از جمله اسید هیدروکلریک، اسید نیتریک، اسید فسفریک و بسیاری دیگر از مواد شیمیایی صنعتی استفاده میشود.
پالایش نفت
فرآیند پالایش نفت خام مستلزم استفاده از اسید به عنوان کاتالیزور است و اغلب برای این منظور از اسید سولفوریک استفاده میشود.
فرآوری فلزات
در پردازش فلزات برای حذف ناخالصی ها، زنگ زدگی یا رسوب از سطح، مانند فولادسازی استفاده میشود. امروزه استفاده از اسید سولفوریک برای این منظور اندکی کاهش یافته است زیرا صنعت در حال حاضر به استفاده از اسید کلریدریک تمایل دارد. اگرچه اسید کلریدریک گرانتر از اسید سولفوریک است، اما سریعتر نتیجه میدهد و از دست دادن فلز پایه در طول فرآیند را به حداقل میرساند.
ساخت منسوجات نیمه مصنوعی
ریون منسوجات از الیاف سلولزی مشتق شده از چوب ساخته شده است. اینها در محلول مس تترا آمین (II) حل می شوند تا مایع غلیظ آبی تولید شود که سپس به اسید سولفوریک تزریق می شود تا الیاف ریون را تشکیل دهد. ریون به عنوان یک منسوجات نیمه مصنوعی خوب در نظر گرفته می شود و میتواند با ابریشم برای پارچه و درخشندگی رقابت کند. در واقع، گاهی اوقات از آن به عنوان “ابریشم هنری” یاد میشود. به راحتی رنگ میشود و پارچه نرم، خنک و صاف است. با این حال، بر خلاف ابریشم، ریون حرارت بدن را عایق نمیکند، بنابراین برای استفاده در کشورهای مرطوب و گرم بسیار مناسب است.
ساخت باتری های سربی اسیدی
باتری های نوع سربی اسیدی در صنعت خودروسازی برای خودروها و کامیون ها استفاده میشود. باتریهای سربی اسیدی در سال 1859 توسط کارخانه گاستون فرانسوی اختراع شد. اسید سولفوریک به شکل رقیق استفاده میشود تا به عنوان یک الکترولیت عمل کند تا جریان الکترونها بین صفحات در باتری جریان یابد. اسید سولفوریک که در این روش استفاده میشود معمولاً اسید باتری نامیده میشود. با توجه به سازنده باتری میتواند از نظر قدرت متفاوت باشد اما به طور کلی بین 28 تا 32 درصد یا بین 4.2 تا 5 مولار است.
کشاورزی
کشاورزان سیبزمینی از پیمانکاران متخصص استفاده میکنند تا مزارع سیبزمینی خود را قبل از برداشت سمپاشی کنند تا در طی یک یا دو روز رویه های سبز از بین رفته و سیاه شوند. این به خشک شدن ساقه کمک میکند و از گره خوردن آنها در تجهیزات برداشت جلوگیری میکند. روش معمول سمپاشی رویه سیبزمینی با محلول اسید سولفوریک است.
ساخت دارو
داروهای شیمی درمانی برای درمان انواع سرطان استفاده میشود. سلولهای سرطانی نسبت به سلولهای طبیعی به آسیب DNA حساستر هستند، بنابراین در شیمیدرمانی، سلولهای سرطانی با آسیب رساندن به DNA خود از بین میروند. این فرآیند به عنوان آلکیلاسیون DNA شناخته میشود و از نوعی دارو به نام عوامل ضد نئوپلاستیک آلکیله کننده استفاده میشود. اسید سولفوریک در فرآیند تولید این گونه داروها استفاده میشود.
مصارف خانگی
کاربرد اسید سولفوریک معمولاً در محصولات تمیز کننده خانگی یافت میشود ، اگرچه فقط به این استفاده محدود نمیشود. دلیل متداول استفاده در تولیدات محصولات خانگی به خاصیت خورندگی آن مربوط میشود. این امر باعث میشود تا انتخاب عالی برای محصولاتی مانند پاککنندههای کاسه توالت و پاککنندهها / بازکنندههای تخلیه چاه باشد.
این اسید در غلظتهای بالا اغلب ماده اصلی پاککنندههای اسیدی است که برای از بین بردن چربی و غیره استفاده میشود مشابه نسخههای قلیایی آنها ، این محصولات میتوانند چربیها و پروتئینها را از طریق هیدرولیز حل کنند. علاوه بر این ، از آنجا که اسید سولفوریک غلیظ دارای خاصیت کم آبی قوی است ، میتواند از طریق فرآیند دهیدراته شدن ، الیاف کاغذی را نیز از بین ببرد. از آنجا که ممکن است اسید با آب واکنش شدیدی نشان دهد ، باید چنین بازکنندههای تخلیه اسیدی را به آرامی به لوله اضافه کرد تا تمیز شود.
برخی دیگر از کاربردهای سولفوریک اسید در شکل شماره 2 آورده شده است.
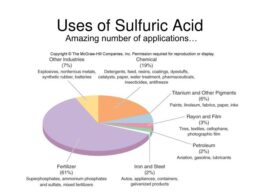
اهمیت سولفوریک اسید در اقتصاد
اسید سولفوریک دارای بازاری بالغ بر 242.6 میلیون تن تولید و ارزش بیش از 20 میلیارد دلار، بزرگترین بازار در میان کالاهای شیمیایی به شمار میرود. با توجه به سهم 87 درصدی واحدهای تولید اسید از گوگرد و گازهای خروجی واحدهای ذوب، نشان از اهمیت این دو بخش در بخش عرضه بازار اسید سولفوریک دارد.
اهمیت استراتژیک اسید سولفوریک
اصلی ترین علت استفاده بالا از اسید سولفوریک یا همان جوهر گوگرد، تولید اسید فسفریک است. به این نکته توجه داشته باشید که اسید فسفریک در هیچ نقطه از دنیا هیچ گونه جایگزینی ندارد. یکی دیگر از مزایای مهم استفاده از اسید سولفوریک قیمت پایین آن است.
تولید کودها ، به ویژه کودهای فسفات از اسید فسفریک فرآیند مرطوب ، اصلی ترین بازار استفاده نهایی اسید سولفوریک است که بیش از 60 ٪ از کل مصرف جهان را در سال 2020 تشکیل میدهد. انتظار میرود این سهم تا سال 2025 کمی کاهش یابد ، عمدتاً به این دلیل که عمدتا به این دلیل کاهش مییابد. انتظار میرود که شستشوی فلزی و کاربردهای آن در صنعت فولاد با سرعت بیشتری رشد کنند. حدود 14 ٪ اسید سولفوریک جهانی برای حدود 20 فرآیند شیمیایی مصرف میشود.
کشور های تولید کننده و مصرف کننده اسید سولفوریک
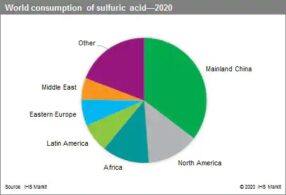
سالانه بیش از یک میلیون تن اسید سولفوریک تنها در انگلستان ساخته میشود. پیشبینی میشود تقاضای جهانی اسید سولفوریک طی پنج سال آینده افزایش یابد. چین بازار بزرگ ا و بیش از 35 ٪ مصرف در سال 2020 را تشکیل میدهد و پس از آن آمریکای شمالی با حدود 13 ٪. آفریقا ، آمریکای لاتین ، اروپای شرقی و غربی و خاورمیانه نیز کاربران بزرگی هستند. پیشبینی میشود تقاضای کود برای اسید سولفوریک در دوره پیشبینی به طور پیوسته افزایش یابد ، در حالی که انتظار می رود تقاضا برای استفاده شیمیایی و صنعتی با سرعت کمی بالاتر رشد کند.
مهم ترین کاربرد اسید سولفوریک در کدام صنعت است؟
تولید کودها ، به ویژه کودهای فسفات از اسید فسفریک فرآیند مرطوب ، اصلی ترین بازار استفاده نهایی اسید سولفوریک است که بیش از 60 ٪ از کل مصرف جهان را در سال 2020 تشکیل میدهد.
خطرات اسید سولفوریک چیست؟
- سوختگی شدید پوست و چشم ها تا حدی که با چشم تماس مستقیم داشته باشد موجب کوری نیز میشود.
- تولید گازهای آلوده و خطرناک که ناشی از غلظت بالای جوهر گوگرد ترکیب شده با آب میباشد.
- آسیب دیدن دهان و گلو ناشی از خوردن این ماده شیمیایی که حتی با احتمال آسیب دیدگی شدید و مرگ نیز نیز همراه خواهد بود.
- احتمال انفجار یا احتراق در صورت تولید گاز هیدروژن که ناشی از واکنش سولفوریک با فلزات می باشد.