فرم تماس با ما
ماده شیمیایی محلول بافر (Buffer Solvent)
محلولهای بافر یا تامپون محلولهایی هستند که pH آنها در اثر افزودن مقدار کمی اسید یا باز تغییر چندانی نمیکند. مکانیزم عملکرد محلولهای بافر به گونهای است که میتواند هم اسید و هم باز اضافه شده را خنثی کند به عبارت دیگر یک محلول بافر هم خنثی کننده اسید و هم خنثی کننده باز است. این محلولها برای سیستمهای شیمیایی و بیولوژیک بسیار مهم هستند. محلولهای بافر به منظور کنترل pH گل حفاری به کار برده میشوند. یکی از مواد مورد استفاده در جهت تنظیم pH سیال حفاری MgO است. MgO در pH های زیر 10 در سیال حفاری حل شده و pH را 10 افزایش میدهد.
ایمنی ماده شیمیایی محلول بافر (Buffer Solvent)
- حفاظت پوست :
از تماس مستقیم پوست با این ماده جلوگیری کنید. در صورت تماس با پوست شسته شود. - حفاظت چشم :
از تماس مستقیم چشم با این ماده جلوگیری کنید. در صورت تماس با چشم شسته شود. در محیط کار چشم شور موجود باشد. - حفاظت بدن :
هنگام کار با آن می بایست از کلاه ایمنی، لباس آستین بلند و دستکش استفاده کرد. در محیط کار دوش آب موجود باشد. - حفاظت تنفسی :
محیط کار حتما مجهز به سیستم تهویه باشد تا ذرات ریز داخل سیستم تنفسی نشود. در محیط دارای گرد و غبار از ماسک بینی استفاده شود.
روش تولید ماده شیمیایی محلول بافر (Buffer Solvent):
محلول های بافر متشکل از یک اسید ضعیف و نمک آن و یا یک باز صعیف و نمک آن هستند از جمله این ترکیبات :
- CH3COOH , CH3COONa
- HF , KF
- NH4OH , NH4Cl
- KH2PO4 , K2HPO4
کاتیون نمک تاثیری در عملکرد بافر ندارد یا به زبان ساده تر در ترکیب بی خاصیت است بنابراین بافرها را میتوان به صورت زیر نمایش دارد:
- CH3COOH , CH3COO
آنیون هایی که خاصیت آمفوتری دارند نیز میتوانند با باز مزدوج خود یک محلول بافری بسازند :
- H2PO4 ,HPO42
- HCO3– , CO32
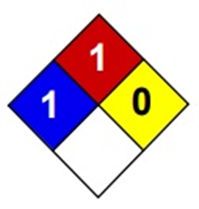
مشخصات ماده شیمیایی محلول بافر (Buffer Solvent) :
ظاهر | مایع آبی رنگ |
pH | 5/4-5/5 |
دانسیته | 12/1 gr/cm3 |
مکانیزم عملکرد ماده شیمیایی محلول بافر (Buffer Solvent) :
در یک محلول بافر تفکیک اسید به حالت تعادل رسیده ونمک آن نیز به طور کامل یونیده می شود چنانچه به این مخلوط تعادلی اسید اضافه کنیم یون +H حاصل از تفکیک اسید تعادل را دچار آشفتگی میکند تعادل طبق اصل لوشاتلیه در جهت مصرف این یون بوتولید HA حرکت میکند در این بین نمک اسید ضعیف تامین کننده منبع فراوان یون های -Aبرای تبدیل یون -A به اسید است .
وقتی به این بافر باز اضافه کنیم یون -OH حاصل از تفکیک باز با یون+H به شکل آب خارج می گردد یعنی وقتی باز اضافه میکنیم از یک طرف یون –OH وارد می شود واز طرف دیگر جذب+ H شده وخارج میشود اسید نیز هرچه بیشتر تفکیک میشود تا +H کافی برای خنثی کردن تمامی باز فراهم کند
شرکت راینه داران با بهره مندی از زنجیره تأمین کارا و در اختیار داشتن شبکه تأمین مواد شیمیایی در داخل و خارج از کشور امکان واردات و تأمین مواد شیمیایی از تولید کنندگان معتبر بین المللی را همواره دارا میباشد.