یون عامل اسیدی و یون عامل بازی یا قلیایی میباشد. یک محلول خنثی به این معنا است که تعداد دو یون مذکور در یک محلول به یک اندازه میباشد و محلول به حالت تعادل در آمده است. اگر به هر علتی میزان دو یون مذکور در محلول تغییر کند، محلول از نظر اسیدی یا قلیایی بودن تغییر میکند. به طور عملی برای مشخص کردن اسیدی یا قلیایی بودن یک محلول، میزان یون را در محلول به عنوان pH سنجیده میشود.
pH یک محلول از 0 تا 14 متغیر میباشد. pH بین 0 تا 7 اسیدی و 7 تا 14 قلیایی است و pH با مقدار 7 خنثی بودن محلول را نشان می دهد. شکل (1) نشان دهنده گستره تغییرات pH برای محلولهای اسیدی، خنثی و بازی است.
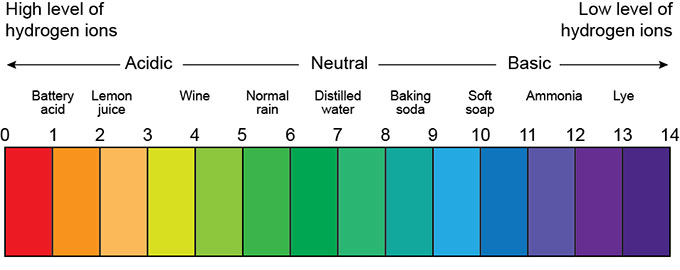
شکل (1): گستره تغییرات pH برای محلولهای اسیدی، خنثی و بازی
محلول بافر (Buffer solution) یک محلول شیمیایی به رنگ آبی و به صورت مایع میباشد که دارای نامهای دیگری نظیر بافر یون هیدروژن نیز است. این محلول از ترکیب ماده اسیدی بسیار ضعیف و همچنین باز بسیار ضعیف به همراه نمک آن باز ساخته میشود به طوری که میتوان گفت این ماده به نوعی هم میتواند خاصیت اسیدی داشته باشد و هم خاصیت بازی و به طور مطلق نمیتوان آن را در دسته بازها و یا اسیدها قرار داد به همین دلیل از ویژگی های این محلول میشود به قابلیت خنثی کنندگی اسیدها و هم خنثی کنندگی بازها اشاره کرد.
مشاهده و ثبت سفارش ماده شیمیایی محلول بافر (Buffer Solvent)
در گروه راینه
انواع محلول بافر
دو نوع بافر وجود دارد:
- بافر اسیدی
- بافر بازی
بافر اسیدی از یک محلول بافر حاوی مقدار متعددی از اسید ضعیف و نمک آن با یک باز قوی شکل میگیرد، بنابراین عنوان بافر اسیدی به آن داده می شود. چنین محلول های بافری دارای pH اسیدی یعنی کمتر از 7 می باشند.
در تعریف به بافری بازی گویند که از یک محلول بافری حاوی مقادیر نسبتا متعددی از باز ضعیف به همراه نمک آن با یک اسید قوی تشکیل شده باشد و در نتیجه نام آن محلول بافر بازی می باشد. pH چنین بافر هایی بازی یعنی بیشتر از 7 می باشد.
جهت محاسبه pH محلول بافرهای اسیدی و بازی از معادلهای که نخستین بار توسط دو شیمیدان به نامهای لورنس ژوزف هندرسون و کارل آلبرت هاسلبالخ ارائه شد. این معادله به صورت زیر تعریف میگردد:
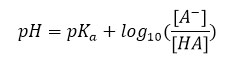
در این رابطه غلظت مولی اسید نامحلول ضعیف، [HA] غلظت باز مزدوج این اسید و عبارت است از که در آن ثابت تفکیک اسیدی است. با استفاده از رابطه فوق میتوان pH محلولهای اسیدی و بازی را به ترتیب به صورت زیر به دست آورد:
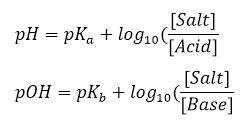
در این روابط و به ترتیب محتوای تفکیک اسیدی اسید ضعیف و محتوای تفکیک بازی باز ضعیف هستند.
به طور صنعتی، از محلولهای بافری در فرآیندهای زیر استفاده میشود:
- فرآیندهای تخمیری
- الیاف رنگی
- در آنالیز شیمیایی و کالیبراسیون pH مترها
- صنعت آبکاری
- صنعت تولید چرم های طبیعی و صنعتی
- تهیه مواد عکاسی