اکسیداسیون پيشرفته
در ارزيابي فرآيندهاي اکسيداسيون پيشرفته با توجه به نکاتي نظير واکنش پذيري نسبي آلاينده مورد نظر با راديکال OH، ميزان ماده اکسيد کننده مورد نياز، اثرات عوامل نابود کننده راديکال، درجه حرارت، pH و نسبت غلظت ماده اکسيد کننده به آلاينده ها ضروري مي باشد.
فرآيندهاي اکسيداسيون پيشرفته فوتوشيميايي ترکيبي از اشعه ماوراء بنفش و يک اکسيد کننده (مانند پراکسيد هيدروژن ، ازون و… ) مي باشد که در غالب موارد سبب توليد راديکال هاي هيدروکسيل و در ادامه واکنش ها سبب اکسيداسيون و تخريب ريزآلاينده ها در فرآيند هاي تصفيه پساب، با اين راديکال خواهد شد.
راديکال هاي هيدروکسيل در واکنش دادن با مواد آلي داراي انتخاب پذيري جزئي مي باشد که اين نکته براي يک ماده اکسيدکننده يک امتياز محسوب مي شود. انتخاب پذيري اين راديکال به نحوي است که مواد مختلف آلي با ساختارهاي طولاني و يا مولکول هاي حاوي پيوندهاي غير اشباع مانند آلکان هاي کلردار بسيار مستعد براي اکسايش با اين راديکال مي باشند، ولي مولکول ساده مانند استيک ، مالئيک و اگزاليک اسيد نمي توانند با OH واکنش دهند. مولکولهاي اشباع بسيار مشکل تر با OH واکنش مي دهند و داراي ثوابت سرعت کوچکي مي باشند و به سختي اکسيد مي شوند. مکانيزم اکسايش مواد با OH بستگي به نوع ماده آلي دارد که به دوصورت مي تواند اتفاق بيافتد:
- راديکال OH با گرفتن يک هيدروژن از مولکول آلي تبديل به مولکول آب گردد مانند آلکان ها يا آلکين ها.
- روش دوم که در مورد الفين ها و آروماتيک ها اتفاق مي افتد، افزوده شدن اين راديکال به ساختمان مولکولي مواد و شکستن پيوندهاي آنهاست.
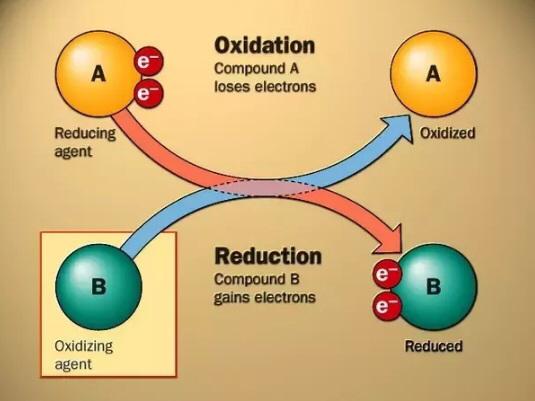
سرعت تخريب مواد آلاينده تقريباً متناسب با ثابت سرعت واکنش آلاينده با راديکال هيدروکسيل است. مكانيزم اصلي در فرايند اكسيداسيون پيشرفته، توليد راديكال هاي آزاد واكنش پذير است. راديكالهاي هيدروكسيل در تخريب تركيبات آلي شيميايي موثر هستند. اين راديكالهاي الكترون دوست به سرعت با نزديكترين تركيب آلي الكترون دار وارد واكنش مي شوند. پتانسيل اكسيداسيون راديكال هاي هيدروكسيل برابرv 33/2مي باشد. همچنين سرعت واكنش اكسيداسيون اين راديكال ها نسبت به اكسيدان هاي مرسوم بيشتر است.
پس از قرارگيري راديكالهاي هيدروكسيل در مجاورت تركيبات آلي شيميايي اين دو تركيب وارد واكنش شده (رابطه 1)، هيدروژن موجود در تركيبات آلي شيميايي جذب راديكالها ميشود (رابطه 2) در نهايت انتقال الكترون مطابق رابطه 3 صورت ميگيرد.

جداول
در جدول (1) پتانسيل اکسيداسيون برخي از اکسيدکنندههاي متداول ارائه شده است با توجه به اين جدول مشاهده مي شود که بعد از فلوئور ، قوي ترين اکسيدکننده، راديکال هيدروکسيل مي باشد.
جدول (1): پتانسيل اکسيداسيون اکسيد کنندهها و قدرت نسبي اکسيداسيون آنها
| ماده اکسيد کننده | قدرت نسبي اکسيداسيون | پتانسيل اکيداسيون (ولت) |
| فلوئور | 23/2 | 03/3 |
| راديکال هيدروکسيل | 06/2 | 80/2 |
| اکسيژن اتمي | 78/1 | 42/2 |
| ازون | 52/1 | 07/2 |
| پراکسيد هيدروژن | 31/1 | 78/1 |
| راديکال پرهيدروکسيل | 25/1 | 70/1 |
| پرمنگنات پتاسيم | 24/1 | 68/1 |
| اسيد هيپو برمو | 17/1 | 59/1 |