در منابع مختلف تعاریف متعددی در خصوص واکنشهای شیمیایی ارائه شده است، در یک تعریف ساده و کلی میتوان گفت واکنشهای شیمیایی مجموعهای از تغییرات هستند که منجر به حرکت شدید الکترونها در تشکیل و شکستن پیوندهای شیمیایی برای تغییرات ذرات ابتدایی میشوند.
به منظور نشان دادان یک واکنش شیمیایی با استفاده از نمادها از معادلهی شیمیایی استفاده میشود. در معادلات شیمیایی نشان داده میشود که مجموعهای از مواد، واکنشدهندهها، به مجموعهی دیگری از مواد یا محصولات، تبدیل میگردند.
انواع واکنشهای شیمیایی
تنوع بسیار زیاد واکنشهای شیمیایی و روشهای مطالعهی آنها منجر به پدید آمدن دستهبندیهای متعدد شده است، مهم ترین و متداول ترین واکنشهای شیمیایی عبارتند از:
- ایزومریزاسیون
- ترکیب مستقیم (سنتز)
- تجزیهی شیمیایی
- واکنش جابهجایی یا جانشینی یگانه
- واکنش جانشینی دوگانه
- واکنشهای اسید و باز
- واکنش اکسایش-احیا
- احتراق
مشاهده و ثبت سفارش آنتی اکسیدانت در گروه راینه
در ادامه تشریح مختصری در خصوص این موارد بیان شده است.
ایزومریزاسیون: در واکنش ایزومریزاسیون یا همپاری یک ترکیب شیمیایی دستخوش یک بازسازی ساختاری بدون هیچ تغییری در ترکیب اتمی خالص خود میگردد.
ترکیب مستقیم یا سنتز: در این حالت دو تا تعداد بیشتری عنصر یا ترکیب برای تشکیل یک محصول که از نظر ساختاری پیچیده تر است به هم میپیوندند. شناخته شده ترین واکنش سنتز، واکنش تولید آمونیاک از نیتروژن و هیدروژن است که علاوه بر کاربرد در صنعت به عنوان خوراک اصلی واحد تولید اوره نیز شناخته میشود:
N2+3H2 → 2NH3
تجزیه شیمیایی: واکنش تجزیه عکس واکنش ترکیب است و در طی این واکنش یک ترکیب به ترکیبات یا عناصر کوچکتر تجزیه میگردد. متداول ترین مثال برای این نوع واکنشها میتوان به تجزیه آب به دو عنصر هیدروژن و اکسیژن اشاره کرد:
2H2O→ 2H2 + O2
واکنش جابهجایی یا جانشینی یگانه: در این نوع واکنش یک عنصر واکنشپذیرتر جایگزین یک عنصر دیگر در ساختار ترکیب اولیه میگردد. برای مثال میتوان به جایگزینی اتم هیدروژن در ترکیب آبی هیدروکلریک اسید با سدیم در واکنش زیر و تولید هیدروژن و نمک سدیم اشاره کرد.
2Na + 2HCL → 2NaCl + H2
واکنش جانشینی دوگانه: در واکنش جانشینی دوگانه عناصر، یونها و یا پیوندهای دو ترکیب برای تشکیل دو ترکیب جدید مبادله میشوند. برای مثال میتوان به واکنش زیر اشاره کرد:
2NaCl + AgNO3→ NaNO3 + AgCl
واکنشهای اسید و باز: همانطور که از نام آن مشخص است، در این نوع واکنش، یک اسید و یک باز با هم واکنش میدهند. واکنش زیر نشان دهنده یک مثال از واکنش سدیم هیدروکسید (باز) و اسید سولفوریک (اسید) است.
2NaOH + H2SO4→ 2H2O + Na2SO4
مثال هایی از واکنشهای اسید و باز عبارتند از:
- تولید آمونیاک در فرآیند هابر
- تولید سدیم هیدروکسید در فرآیند کلر زدایی
- تولید اسید سولفوریک در فرآیند های صنعتی
واکنشهای آلی: با توجه به چهار ظرفیتی بودن اتم کربن، واکنشهای آلی دستهی وسیعی از واکنشها هستند و ترکیباتی را شامل میشوند که کربن عنصر اصلی در ساختار مولکولی آنها است. واکنشهای آلی بر اساس گروههای عاملی موجود در آنها به دستههای مختلفی تقسیم میشوند.
واکنش های اکسیداسیون: در این نوع واکنش ها، یک ماده با اکسیژن واکنش می کند و الکترون های آن به ماده دیگری منتقل می شوند. برخی از متداول ترین مثال های این نوع واکنش ها عبارتند از:
- سوختن چوب
- تولید دی اکسید کربن در خودروها
- تولید اکسیژن در فرآیند فتوسنتز
واکنش های احیا: در این نوع واکنش ها، یک ماده الکترون های خود را به ماده دیگری منتقل می کند. مثالهایی از این نوع واکنش ها عبارتند از:
- تولید فلزات از سنگ معدن
- تولید هیدروژن در راکتور های هیدروژن
- تولید آمین ها در فرآیند های شیمیایی
واکنش های تشکیل پلیمر: در این نوع واکنش ها، مولکول های کوچک به هم متصل شده و پلیمرهای بزرگ تشکیل می دهند. مثال هایی از این نوع واکنش ها عبارتند از:
- تولید پلاستیک
- رزین ها
- فایبرگلاس
همان طور که در بالا نیز به آن اشاره شد واکنش های اکسایش و احیا یکی از مهمترین واکنش های شیمیایی هستند. در این واکنش ها، الکترون ها به صورت تبادلی بین اتم ها جابجا می شوند و در نتیجه یکی از اتم ها اکسایش و دیگری احیا می یابد.
شکل (1) نشان دهنده شمایی ساده از چگونگی تبادل الکترون در یک واکنش اکسایش – احیا است.
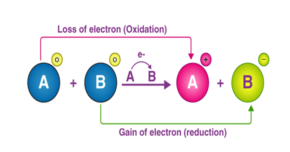
شکل (1): شمایی ساده از چگونگی تبادل الکترون در یک واکنش اکسایش – احیا
در ادامه، به بررسی و توضیح واکنش های اکسایش و احیا در شیمی پرداخته خواهد شد.
چگونگی انجام واکنش های اکسایش و احیا
واکنش های اکسایش و احیا به صورت تبادل الکترون بین دو مولکول یا یک مولکول و یون انجام می شود. در واکنش اکسایش، یک مولکول یا یون الکترون از خود ترک می کند و در نتیجه اتم یا یون دارای بار مثبت میشود.
در واکنش احیا، یک مولکول یا یون الکترون را به خود جذب می کند و در نتیجه اتم یا یون دارای بار منفی می شود.
تشخیص واکنش های اکسایش و احیا
برای تشخیص واکنش های اکسایش و احیا، باید تغییرات بار الکتریکی اتم ها را بررسی کرد. اگر بار الکتریکی یک اتم در واکنش افزایش یابد، به عنوان واکنش اکسایش شناخته می شود. اگر بار الکتریکی یک اتم در واکنش احیا یابد، به عنوان واکنش احیا شناخته می شود.
نیم واکنش های اکسایش و احیا
همیشه در واکنشهای اکسایش – احیا باید این نکته را در نظر گرفت که از دست دادن الکترون يا گرفتن الكترون به تنهايي انجام نمی شود. به واكنشهای فرضي كه در آن يك عنصر تنها الكترون بگيرد و يا الكترون از دست بدهد يك نيم واكنش گفته می شود.
به عبارت دیگر میتوان گفت در واقع نیم واکنش به نیمی از یک واکنش اکسایش ـ احیا که در سمت چپ یا راست آن الکترون آزاد وجود دارد گفته می شود. بدیهی است وجود الکترون در این واکنشها در صورتی وجود خواهد داشت که در این نیم واکنش ها، موادی به صورت یون (با بار مثبت یا منفی) وجود داشته باشند.
به منظور بررسی دقیق تر این موضوع واکنش زیر را در نظر بگیرید:
Zn(s) + Cu+2(aq) → Zn+2(aq) + Cu(s)
نیمه واکنش اکسیداسیون (اکسایش)
به طور کلی میتوان گفت واکنش هایی که طی آن ماده ای الکترون از دست می دهد و عدد اکسایش آن افزایش می یابد، نیم واکنش اکسایش گفته می شود.
در نیمه واکنش های اکسایش، الکترون ها در سمت راست نیمه واکنش نوشته می شوند و این نیمه واکنش گرمازا می باشد. واکنش زیر به عنوان نیم واکنش اکسایش در نظر گرفته میشود:
Zn(s) → Zn+2(aq) + 2e-1
نیمه واکنش احیا
به طور کلی میتوان گفت واکنشهایی که طی آن ماده ای الکترون از میگیرد و عدد اکسایش آن احیا مییابد، نیم واکنش احیا گفته می شود. در نیمه واکنش های احیا، الکترون ها در سمت چپ نیمه واکنش نوشته میشوند و این نیمه واکنش گرماگیر می باشد. واکنش زیر به عنوان نیم واکنش احیا در نظر گرفته میشود:
Cu+2(aq) + 2e-1 → Cu(s)
تفاوت بین واکنش های اکسیداسیون و احیا
واکنش های اکسیداسیون، واکنش هایی هستند که در آن الکترون از یک مولکول یا یون خارج می شود. در واکنش های احیا، الکترون به یک مولکول یا یون اضافه می شود.
به عبارت دیگر، واکنش های اکسیداسیون، واکنش هایی هستند که باعث افزایش بار مثبت یک اتم می شوند و واکنش های احیا، واکنش هایی هستند که باعث افزایش بار منفی یک اتم می شوند.
انواع واکنش های اکسیداسیون
واکنش های اکسیداسیون را می توان براساس مبادله هیدروژن، مبادله اکسیژن، مبادله الکترون و تعریف اکسایش در شیمی دسته بندی کرد.
مبادله هیدروژن: در این نوع واکنش، یک مولکول یا یون هیدروژن را از خود ترک می کند. به عنوان مثال، در واکنش زیر، فلز منیزیم به عنوان اتم اکسیده کننده عمل می کند و هیدروژن به عنوان اتم تقلیل دهنده عمل می کند.
Mg + H2 → MgH2
مبادله اکسیژن: در این نوع واکنش، یک مولکول یا یون اکسیژن را از خود ترک می کند. به عنوان مثال، در واکنش زیر، فلز آهن به عنوان اتم اکسیده کننده عمل می کند و اکسیژن به عنوان اتم تقلیل دهنده عمل می کند.
4Fe + 3O2 → 2Fe2O3
مبادله الکترون: در این نوع واکنش، الکترون ها بین دو مولکول یا یون جابجا می شوند. به عنوان مثال، در واکنش زیر، فلز روی به عنوان اتم اکسیده کننده عمل می کند و فلز مس به عنوان اتم تقلیل دهنده عمل می کند.
Cu + 2AgNo3 → Cu(NO3)2 + 2Ag
فرآیند اکسیداسیون
فرآیند اکسیداسیون در سال 1987 توسط Glaze و همکارانش معرفي شد. براساس تعريف، اکسايش پيشرفته به فرآيندهايی اطلاق می شود که درآنها راديکال های آزاد خصوصاً راديکال هيدروکسيل OH به اندازه کافی توليد شده و مواد شيميايی آلی غيرقابل تجزيه موجود در محيط واکنش در شرايط محيطی با آن اکسيد شوند. راديکال هيدروکسيل جزء مواد اکسيدکننده بسيار فعال است که اکثر مواد آلي را مورد حمله قرار مي دهد. سينيتيک واکنش معمولاً از درجه اول نسبت به غلظت راديکال هيدروکسيل و نسبت به غلظت ماده اکسيد شونده است . مکانيزم اکسيدشدن مواد با OH بستگي به نوع ماده آلي دارد.
فرآيند اکسايش پيشرفته بر نحوه توليد راديکال OH در واکنش اکسايش می باشند. تصفيه پسابهای حاوی آلايندهای مختلف مانند ترکيبات زیر توسط روش اکسایش فوتوکاتالیستی در پژوهشهای مختلف بررسی شده است:
- ترکیبات فنلی
- الکل ها
- اسيدهاي آلی
- ترکيبات هيدروکربني گوگرد دار
- مواد ضد آفت و حشره کش
فرآيندهايی که درآنها از تأثير نور ماوراء بنفش برعملکرد کاتاليستها درشرايط واکنش استفاده می شود، تحت عنوان واکنش هاي فتوکاتاليستی معرفي مي شوند. از خصوصيت اصلی کاتاليست هاي حساس به نور، خاصيت نيمه هادي بودن آنها می باشد. شناخت فوتوکاتاليست ها مستلزم آشنايی به طبيعت نيمه هادی ها است.
در مراحل آغازين فرآيندهاي اکسيداسيون پيشرفته منجر به توليد راديکال های آزاد هيدروکسيل می گردد که با پتانسيل اکسيداسيون بالا بيشترين کارايی را در ميان ساير اکسندهها در اکسيداسيون ترکيبات آلی دارد.
طول عمر راديکال هيدروکسيل خيلی کوتاه است اما از نظر پتانسيل اکسيد کنندگي به قدری قوی است که می تواند به راحتی با جذب هيدروژن سبب اکسيداسيون يک ترکيب آلی گردد. مکانيسم واکنش راديکال هيدروکسيل با ترکيبات آلی بسيار پيچيده است. اين مکانيسم و به طور کلی واکنش های راديکالی را می توان به اختصار در سه مرحله بيان نمود:
- واکنشهای اوليه يا آغازين که در اين مرحله راديکال های آزاد توليد ميگردد.
- واکنشهای انتشاری که در اين مرحله راديکالهاي توليد شده از مرحله قبل به راديکالهای آزاد ديگر تبديل می گردد.
- واکنشهای پايانی که در اين مرحه راديکالهای آزاد مرحله قبل به يک ترکيب پايدار تبديل می گردند.
از نقطه نظر سينتيکی واکنش هاي مرتبط به راديکالهاي OH بسيار سريع تر از ساير اکسيد کننده ها می باشند. با اين وجود در اثر واکنش راديکال هيدروکسيل با ترکيبات آلی تعداد بسيار زيادی ترکيبات واسطه توليد مي کند که اين ترکيبات واسطه توليدی، خود به عنوان رقيب ترکيبات اوليه با راديکال OHوارد واکنش گرديده و اصطلاحا به عنوان نابود کننده راديکال OH عمل مي کنند. بنابراين تخريب کامل معدنی شدن-يک ترکيب آلی در شرايط خاصی که غلظت راديکال OH بسيار زياد بوده و زمان واکنش به حد کافی بالا باشد حاصل خواهد گرديد.
اکسیداسیون پيشرفته
در ارزيابي فرآيندهاي اکسيداسيون پيشرفته با توجه به نکاتی نظير واکنش پذيری نسبی آلاينده مورد نظر با راديکال OH، ميزان ماده اکسيد کننده مورد نياز، اثرات عوامل نابود کننده راديکال، درجه حرارت، pH و نسبت غلظت ماده اکسيد کننده به آلاينده ها ضروری مي باشد.
فرآيندهاي اکسيداسيون پيشرفته فوتوشيميايی ترکيبی از اشعه ماوراء بنفش و يک اکسيد کننده (مانند پراکسيد هيدروژن ، ازون و… ) می باشد که در غالب موارد سبب توليد راديکال های هيدروکسيل و در ادامه واکنش ها سبب اکسيداسيون و تخريب ريزآلاينده ها در فرآيند های تصفيه پساب، با اين راديکال خواهد شد.
راديکال هاي هيدروکسيل در واکنش دادن با مواد آلي داراي انتخاب پذيری جزئي مي باشد که اين نکته براي يک ماده اکسيدکننده يک امتياز محسوب می شود. انتخاب پذيري اين راديکال به نحوی است که مواد مختلف آلي با ساختارهاي طولانی و يا مولکول هاي حاوی پيوندهای غير اشباع مانند آلکان هاي کلردار بسيار مستعد براي اکسايش با اين راديکال مي باشند، ولی مولکول ساده مانند استيک، مالئيک و اگزاليک اسيد نمي توانند با OH واکنش دهند. مولکول های اشباع بسيار مشکل تر با OH واکنش می دهند و دارای ثوابت سرعت کوچکی می باشند و به سختي اکسيد می شوند. مکانيزم اکسايش مواد با OH بستگی به نوع ماده آلی دارد که به دوصورت مي تواند اتفاق بيافتد:
- راديکال OH با گرفتن يک هيدروژن از مولکول آلی تبديل به مولکول آب گردد مانند آلکان ها يا آلکين ها.
- روش دوم که در مورد الفين ها و آروماتيک ها اتفاق می افتد، افزوده شدن اين راديکال به ساختمان مولکولی مواد و شکستن پيوندهای آنهاست.
سرعت تخريب مواد آلاينده تقريباً متناسب با ثابت سرعت واکنش آلاينده با راديکال هيدروکسيل است. مكانيزم اصلي در فرايند اكسيداسيون پيشرفته، توليد راديكال هاي آزاد واكنش پذير است. راديكالهاي هيدروكسيل در تخريب تركيبات آلي شيميايي موثر هستند. اين راديكالهاي الكترون دوست به سرعت با نزديكترين تركيب آلي الكترون دار وارد واكنش مي شوند. پتانسيل اكسيداسيون راديكال هاي هيدروكسيل برابرv 33/2مي باشد. همچنين سرعت واكنش اكسيداسيون اين راديكال ها نسبت به اكسيدان هاي مرسوم بيشتر است.
پس از قرارگيري راديكالهاي هيدروكسيل در مجاورت تركيبات آلي شيميايي اين دو تركيب وارد واكنش شده (رابطه 1)، هيدروژن موجود در تركيبات آلي شيميايی جذب راديكالها می شود (رابطه 2) در نهايت انتقال الكترون مطابق رابطه 3 صورت می گيرد.

در جدول زیر پتانسيل اکسيداسيون برخی از اکسيدکنندههاي متداول ارائه شده است با توجه به اين جدول مشاهده می شود که بعد از فلوئور ، قوی ترين اکسيدکننده، راديکال هيدروکسيل می باشد.
| ماده اکسيد کننده | قدرت نسبي اکسيداسيون | پتانسيل اکيداسيون (ولت) |
| فلوئور | 23/2 | 03/3 |
| راديکال هيدروکسيل | 06/2 | 80/2 |
| اکسيژن اتمی | 78/1 | 42/2 |
| ازون | 52/1 | 07/2 |
| پراکسيد هيدروژن | 31/1 | 78/1 |
| راديکال پرهيدروکسيل | 25/1 | 70/1 |
| پرمنگنات پتاسيم | 24/1 | 68/1 |
| اسيد هيپو برمو | 17/1 | 59/1 |
پتانسيل اکسيداسيون اکسيد کنندهها و قدرت نسبی اکسيداسيون آنها