تیتانیوم دی اکساید
دی اکسید تیتانیم (Titanium Dioxide) یا تیتانیا با فرمول TiO2 دارای وزن مخصوص 2/4-9/3، نقطه ذوب 1854 درجه سانتی گراد و سختی 6/5-5/5 است. دی اکسید تیتانیم در آب و اسیدهای آلی و محلولهای رقیق قلیایی حل نمیشود اما در اسید سولفوریک گرم و HF حل میشود. دی اکسید تیتانیم به صورت سنگهای ایلمینیت (FeTiO3)، پروسکایت (CaTiO3) و تیتانیت ایلمینوروتیل در منابع معدنی یافت میشود.
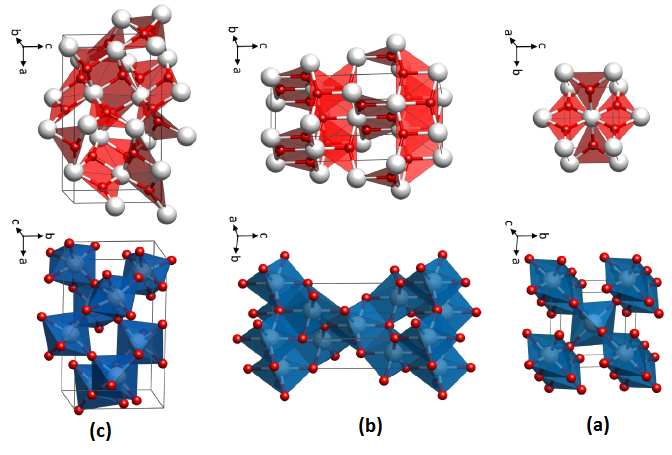
دی اکسید تیتانیم در طبیعت به سه حالت مختلف روتیل، آناتاز و بروکیت یافت می شود. روتیل فراوان ترین و پایدارترین ماده معدنی است که حاوی 98 درصد TiO2 است و در تولید دی الکتریکها و حسگرهای اکسیژن در دمای بالا به کار می رود. آناتاز و بروکیت در اثر حرارت به روتیل تبدیل میشوند. آناتاز یک ماده نیمه رسانا است که به دلیل هزینه کم و قدرت اکسیداسیون قوی در برابر اشعه UV و طبیعت آبدوستی آن عمدتا در پوشش های نوری، رنگ های حساس نوری و کاتالیز نوری مورد استفاده قرار می گیرد. از نظر فضایی، فازهای روتایل و آناتاز تتراگونال هستند و بروکیت اورتورومبیک است. در شکل 1 فازهای ساختاری آناتاز، روتایل و بروکیت مشاهده میشوند.
شکل 1: فازهای ساختاری (a) روتایل، (b) آناتاز و (c) بروکیت
طبق استاندارد ASTM این ماده به صورت رنگدانه در 4 نوع مختلف تولید میگردد:
نوع 1: دارای حداقل 94 درصد TiO2 و نوع گرید آناتاز است و این گرید دارای بیشترین مقاومت میباشد.
نوع 2: دارای حداقل 92 درصد TiO2 و نوع گرید روتایل است و این گرید دارای مقاومت متوسط میباشد.
نوع 3: دارای 90 درصد TiO2 و نوع گرید روتایل است و این گرید دارای مقاومت متوسط میباشد.
نوع 4: دارای 80 درصد TiO2 و نوع گرید روتایل است و این گرید دارای مقاومت بالایی میباشد.
فرآیند تولید تیتانیم دی اکسید
روش تولید دی اکسید تیتانیم بستگی به مواد خام موجود دارد. رایج ترین منبع دی اکسید تیتانیم ماده معدنی ایلمنیت با فرمول FeTiO3 است. بعد از این که سنگ معدن این ماده استخراج شد باید طی دو فرایند و روش ”سولفات” و “کلراید” به شکل خالص آن تبدیل شود.
فرآیند سولفات
در این فرایند لمینت (FeTiO3) یک منبع معمول برای تولید محصول مورد نظر است که با اسید سولفوریک غلیظ واکنش داده و ماده تیتانیوم اکسیژن سولفات (TiOSO4) استخراج می شود و در نهایت به TiO2 تبدیل میگردد.
فرایند کلراید
این فرایند نیاز به خالص ترین سنگ معدنی موجود و یا روتیل دارد که بسیار کمیاب است. مواد خام باید حاوی حداقل 70 درصد از روتیل باشند.تیتانیا در ابتدا بوسیله واکنش دادن با کربن دچار اکسایش می شود و در مرحله بعد این کار با کلر تکرار می شود . سپس مایع TiCl4 بدست آمده توسط تماس با شعله اکسیژن خالص یا پلاسما در دمای 1200 تا 1700 درجه سانتی گراد تقطیر میشود و به TiO2 تبدیل میگردد.
کاربرد تیتانیوم دی اکساید
رنگدانه
استفاده از این ماده به عنوان رنگدانه در فرم اناتاز برای اولین بار در سال 1923 در فرانسه گزارش شد. امروزه تیتانیوم دی اکسید مهم ترین رنگ دهنده یا رنگدانه سفیدی می باشد که علاوه بر رنگ کردن ذرات باعث ایجاد اثر حفاظتی در برابر UV نیز است.
سلولهای خورشیدی
در سلول های خورشیدی این ماده به دلیل داشتن ذرات کوچک و بازتاب نور خورشید میتواند به عنوان بستر سلول های DSSC مورد استفاده قرار بگیرد.
محصولات آرایشی
بدلیل کوچک بودن اندازه نانوذرات این محصول و عدم جذب نور فرابنفش و بازتاب نور مرئی خورشید و در نتیجه به کمک به پیشگیری از سرطان پوست این ماده کاربردهای بسیاری در این محصولات دارد. این ماده در انواع محصولات شخصی از جمله کرم های ضد آفتاب، کرم پودر ها، کرم های سفید کننده و… به عنوان عامل سفید کننده و یا برای فیلتراسیون نور خورشید استفاده میشود.
کاتالیستها
با توجه به اندازه کوچک سایز ذرات و بالا بودن سطح این ماده، TiO2 به عنوان یک نانو ماده اجازه میدهد تا کاتالیست های گوناگونی با فعالیت سطح بالا تولید گردد. به تازگی تحقیقات زیادی برای TiO2 به دلیل سطح بالا و تثبیت کاتالیزورها در ساختار مزوپور به عنوان یک ماده جایگزین برای کاتالیزورهای ناهمگن انجام شده است. به دلیل بازده کوانتومی کم و توانایی جذب کم، هزینههای بالا و مشکلات در جداسازی استفاده از این ماده در صنایع بزرگ به عنوان کاتالیزور و جایگزین مناسب برای کاتالیزورهای ناهمگن محدود گشته است و تحقیقات بر روی این ماده به عنوان یک ماده ی حمایت کننده ی کاتالیست (مثلا به عنوان بستر) ادامه دارد.